Chemie
Hypochlorige Säure
IUPAC-Name : Hypochlorsäure, Chlor (I) säure, Chloranol, Hydroxochlorin
Andere Namen : Wasserstoffhypochlorit, Chlorhydroxid, elektrolysiertes Wasser, elektrolysiertes oxidierendes Wasser, elektroaktiviertes Wasser
CAS-Nummer : 7790-92-3
Molmasse : 52.46 g/mol
Molekularformel : HOCl
Aussehen : Farblose wässrige Lösung
Löslichkeit in Wasser : Löslich
Säure : 7.53
Elektrolyse
In der Chemie und Herstellung ist die Elektrolyse eine Technik, die einen direkten elektrischen Strom (DC) verwendet, um eine ansonsten nicht spontane chemische Reaktion zu steuern. Die Elektrolyse ist kommerziell wichtig als ein Schritt bei der Trennung von Elementen aus natürlich vorkommenden Quellen. Die Elektrolyse von Natriumchlorid (NaCl) und Wasser (H 2 O) kann zur Erzeugung von hypochloriger Säure verwendet werden. Die Elektrolysetechnologie wurde zuerst von Michael Farraday erklärt, als er in den 1830er Jahren die Gesetze der Elektrolyse entwickelte. Die Leitung von elektrischem Strom über zwei Elektroden in einer Salzlösung kann Chlorgas erzeugen, Natriumhypochlorit (Bleichmittel oder NaOCl), hypochlorige Säure, Natriumhydroxid, Wasserstoffgas, Ozon und Spuren anderer naszierender Oxidantien.
Der Schlüsselprozess der Elektrolyse ist der Austausch von Atomen und Ionen durch Entfernen oder Hinzufügen von Elektronen aus dem externen Kreislauf. Ein elektrisches Potential wird über ein Paar Elektroden, die in den Elektrolyten eingetaucht sind, angelegt. Jede Elektrode zieht Ionen an, die die entgegengesetzte Ladung haben. Positiv geladene Ionen (Kationen) bewegen sich zur elektronenliefernden (negativen) Kathode. Negativ geladene Ionen (Anionen) bewegen sich in Richtung der elektronenziehenden (positiven) Anode. In der Chemie wird der Verlust von Elektronen als Oxidation bezeichnet, während der Elektronengewinn als Reduktion bezeichnet wird.
Zum Beispiel ist der erste Schritt bei der Herstellung von Hypochlorsäure die Elektrolyse einer Salzwassersole zur Erzeugung von Wasserstoff und Chlor, die Produkte sind gasförmig. Diese gasförmigen Produkte blasen aus dem Elektrolyten und werden gesammelt.
2 NaCl(s) + 2 H20(l) → 2 NaOH(aq) + H2(g) + Cl2(g)
Membranzellentechnologie
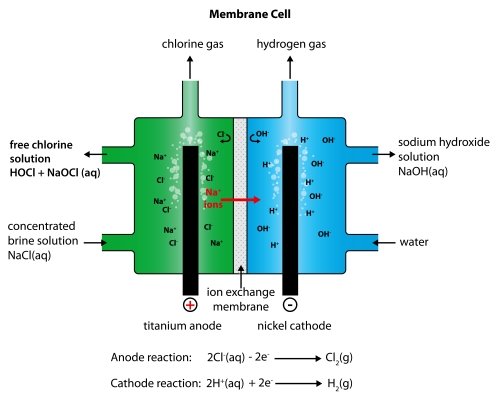
Die Ionenaustauschmembran besteht aus einem Polymer, das nur positive Ionen durchlässt. Das bedeutet, dass nur die Natriumionen aus der Natriumchloridlösung die Membran passieren können und nicht die Chloridionen. Dies hat den Vorteil, dass die im rechten Abteil gebildete Natronlauge niemals mit einer Natriumchloridlösung verunreinigt wird. Die verwendete Natriumchloridlösung muss rein sein. Wenn es irgendwelche anderen Metallionen enthält, würden diese auch die Membran passieren und die Natronlauge kontaminieren.
Wasserstoff wird an der Kathode erzeugt :
2H+(aq) + 2e- → H2(g)
Natriumhydroxid wird an der Kathode erzeugt :
Na+(aq) + OH-(aq) → NaOH(aq)
Chlor wird an der Anode erzeugt :
2Cl-(aq) - 2e- → Cl2(g)
Es ist wegen der Reaktion mit etwas Sauerstoff verunreinigt :
4OH-(aq) - 4e- → 2H2O(l) + O2(g)
Zugabe von Chlor zu Wasser ergibt sowohl Salzsäure (HCl) als auch hypochlorige Säure (HOCl) :
Cl2(g) + H2O ⇌ HOCl(aq) + HCl(aq)
Cl2(g) + 4 OH− ⇌ 2 ClO-(aq) + 2 H2O(l) + 2 e−
Cl2(g) + 2 e− ⇌ 2 Cl-(aq)
Der pH-Wert bestimmt die freie Chlorspezies, die in wässrigen Lösungen vorhanden ist. Bei einem pH-Wert zwischen 5 und 6 beträgt die Chlorspezies nahezu 100% Hypochlorsäure (HOCl). Wenn der pH-Wert unter 5 fällt, beginnt er sich in Cl2 (Chlorgas) umzuwandeln. Ab einem pH-Wert von 6 beginnt es sich in das Hypochlorition (OCl-) umzuwandeln.

Hypochlorige Säure ist eine schwache Säure (pKa von etwa 7,5), was bedeutet, dass sie leicht dissoziiert Wasserstoff und Hypochloritionen, wie in Gleichung erwähnt wird: : HOCl ⇌ H+ + OCl-
Zwischen einem pH-Wert von 6,5 und 8,5 ist diese Dissoziation unvollständig und sowohl HOCl- als auch OCl-Spezies sind in einem gewissen Ausmaß vorhanden. Unterhalb eines pH von 6,5 tritt keine Dissoziation von HOCl auf, während oberhalb eines pH von 8,5 eine vollständige Dissoziation zu OCl- auftritt.
Da die keimtötende Wirkung von HOCl viel höher ist als diejenige von OCl & supmin ;, ist eine Chlorierung bei einem niedrigeren pH-Wert bevorzugt. Die keimtötende Wirksamkeit von Hypochlorsäure (HOCl) ist viel höher als die des Hypochloritions (OCl-). Die Verteilung der Chlorspezies zwischen HOCl und OCl & supmin; wird durch den pH-Wert bestimmt, wie oben diskutiert.
Da HOCl bei niedrigem pH-Wert dominiert, ermöglicht die Chlorierung eine effektivere Desinfektion bei niedrigem pH-Wert. Bei hohem pH-Wert dominiert OCl, was zu einer Verringerung der Desinfektionseffizienz führt.
Bakterien Inaktivierung
Chlor ist ein äußerst wirksames Desinfektionsmittel zur Inaktivierung von Bakterien. Eine in den 1940er Jahren durchgeführte Studie untersuchte die Inaktivierungsgrade als Funktion der Zeit für E. coli, Pseudomonas aeruginosa, Salmonella typhi und Shigella dysenteriae (Butterfield et al., 1943). Die Studienergebnisse zeigten, dass HOCl für die Inaktivierung dieser Bakterien wirksamer ist als OCl-. Diese Ergebnisse wurden von mehreren Forschern bestätigt, die zu dem Schluss kamen, dass HOCl 70 bis 80 Mal wirksamer ist als OCl- für die Inaktivierung von Bakterien (Culp/Wesner/Culp, 1986). Seit 1986 gab es Hunderte von Publikationen, die die Überlegenheit von HOCl gegenüber OCl- (Besuchen Sie die Forschungsdatenbank ).
Die größte Herausforderung bestand darin, Hypochlorsäure bei nahezu neutralem pH anstelle von Chlorgas oder Hypochlorit zu erzeugen, und dies in einer stabilen Form. Hypochlorsäure ist ein metastabiles Molekül. Es möchte zu Salzwasser zurückkehren oder sich zu Hypochlorit umwandeln.
Einzelzellentechnologie
Einer der größten Fortschritte war die Entwicklung der Einzelzellentechnologie, bei der ein einzelner Strom von freiem Chlor ohne ein Nebenprodukt von Natriumhydroxid (NaOH) erzeugt wird. Diese Technologie hat zur Entwicklung von stabileren Lösungen von Hypochlorsäure geführt und ermöglicht eine bessere Kontrolle des pH-Wertes des erzeugten freien Chlors. Da der pH-Wert des Wassers abhängig von seiner Quelle in der Welt unterschiedlich ist, die Veränderung des pH-Werts der Salzlösung ermöglicht eine bessere Kontrolle und Konsistenz bei der Erzeugung einer freien Chlorlösung zwischen pH 5 und 7, die von Hypochlorsäure (HOCl) dominiert wird.
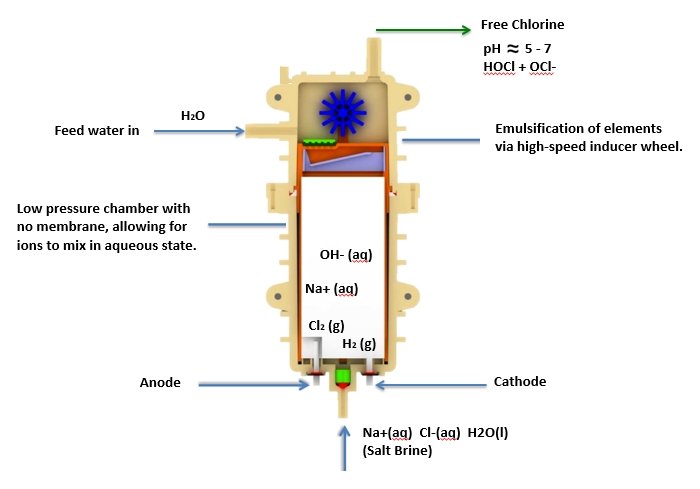
Anodenreaktion :
2Cl-(l) → Cl2(g) + 2e-
Kathodenreaktion :
2H2O(l) + 2e- → H2(g) + 2OH- (aq)
Freie Chlorerzeugung :
Cl2 (g) + H2O → HOCl + HCl
Cl2 (g) + 2OH-(aq) → OCl- (aq) + Cl-(aq) + H2O(l)
Best Hypochlorous Acid (HOCL) Generators
 Portable Hypochlorous Acid (HOCL) Machine
Portable Hypochlorous Acid (HOCL) Machine
Make high quality hypochlorous acid in the home or office.
$159.99 + Free Shipping
 HOCL Machine + Electrostatic Sprayer
HOCL Machine + Electrostatic Sprayer
Make hypochlorous acid and spray with an electrostatic cold fogger.
$309.98 + Free Shipping


